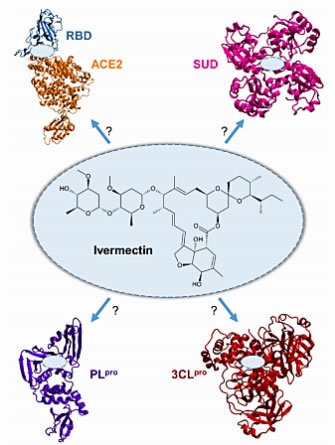
A estrutura química da IVM e a esquematização dos principais alvos estudados nas simulações da dinâmica molecular por Antonio Francés-Monerris e col – 09.08.20. Fonte: chemrxiv.org 2020 https://doi.org/10.26434/chemrxiv.12782258.v1
Um estudo publicado, após cruzar 2,5 bilhões de combinações genéticas do covid-19, pelo Supercomputador Summit – Oak Ridge National Lab, Tennessee revelou uma nova teoria sobre como o Covid-19 afeta o corpo (Garvin, MR; eLife, julho 2020): a bradicinina é a vilã e não as citocinas, o que explica muitos aspectos bizarros da Covid-19, que não eram elucidados pela teoria anterior e também identificou os principais locais onde uma droga antiviral deveria ligar-se, no hospedeiro ou no vírus, para produzir o máximo efeito antiviral.
O vírus adere-se ao receptor da Enzima conversora da Angiotensina 2 (ACE2) da membrana celular usando a glicoproteína Spike, que forma a coroa dos múltiplos espetinhos na camada externa do vírus. Em seguida há fusão da proteína Spike com o receptor da ACE2 e a membrana, que entende que aquele material é adequado à célula e envolve o vírus com uma bolha da membrana celular chamada capsídeo e carreia o vírus para o citoplasma da célula, infectando-a. Esse processo é chamado de endocitose. E, quando o vírus está completamente formado, abre-se a bolha para o espaço extracelular, soltando o vírus por brotamento.
A ACE2 (enzima conversora angiotensina 2 reduz a pressão arterial) e a ACE (angiotensina eleva a pressão arterial) são responsáveis pela regulação pressão arterial no Sistema Renina-Angiotensina. Mas, quando o vírus ocupa o receptor de ACE2 faz o seu papel, que é de intensa vasodilatação e induz a formação de novos receptores de ACE2 no corpo, até onde não existia, permitindo que outros órgãos sejam atingidos pelos efeitos patogênicos do Covid-19. No sangue de pacientes com COVID-19, houve acentuado aumento da Bradicinina, que também é parte do sistema Renina-angiotensina. As consequências principais da ocupação do ACE2 pelo Covid-19 é aumentar a produção da bradicinina, cujo mecanismo no controle da pressão arterial torna-se totalmente desregulado, promovendo vasodilatação mais intensa e extravasamento de líquidos para os tecidos, encharcando o pulmão.
Mas o Covid-19, ao ocupar o receptor da ACE2, também promove aumento da produção do ácido hialurônico no pulmão, que é extremamente ávido por água e forma uma camada gelatinosa (hidrogel) nos alvéolos, que distancia o oxigênio dos vasos a serem alvos das trocas gasosas pulmonares. Essa gelatina intra-alveolar pulmonar é a principal causa da asfixia do paciente, com quedas progressivas da oxigenação sanguínea do paciente, mesmo quando o ventilador está funcionando adequadamente e sabemos que as taxas de óbito dos pacientes que vão para a UTI e são entubados é muito elevada.
A elucidação deste mecanismo da infecção das células pelo Covid-19 mostra que um dos alvos que seria muito importante inativar por uma droga antiviral no tratamento da Covid-19 seria o receptor da ACE 2 (Garvin, MR; eLife, julho 2020), que bloquearia a própria entrada do vírus na célula e suas consequências nefastas.
A tempestade do Covid-19 produzida pela Bradicinina induz vários eventos nefasto: a queda do potássio no sangue induz à fraqueza generalizada, insuficiência cardíaca congestiva, arritmias cardíacas, hipotensão e parada cardíaca. Os vasos que se dilatam ficam hiperpermeáveis e permitem o extravasamento de líquido para os tecidos, queda da pressão arterial e choque. O acúmulo de líquidos no pulmão provoca o edema pulmão e o aumento do ácido hialurônico induzido pelo Covid-19 promove a formação do hidrogel pulmonar e a consequente asfixia, mesmo na presença de ventilador eficaz. No cérebro a inflação da bradicinina induz encefalite, tonturas, cefaleias intensas, confusão mental e isquemia. Nos músculos a bradicinina promove inflamação, fraqueza e fortes dores musculares.
O mecanismo proposto inicialmente para explicar atividade da IVM contra a SARS-CoV-2 é a inibição do transporte nuclear pelas proteínas α / β da importina (Caly L,2020; Wagstaff, 2020; Caly 2012). Mas se a glicoproteína Spiky for bloqueada o vírus não penetra na célula e o Estudo de Dayer M e col de maio 2020 sugere que IVM atua bloqueando entrada do vírus na célula
Segundo estudo de Garvin MR e col. 2020, a tempestade da bradicinina pode ser inativada se a droga antiviral conseguir impedir a ocupação do receptor da ACE2, responsável por desencadear a sequência de eventos: elevação da Bradicinina, desregulação do sistema renina-angiotensina e elevação do ácido hialurônico.
No caso de a infecção já estar mais avançada, com múltiplos vírus ativos secretando suas toxinas, a droga antiviral ideal para tratar o Covid-19 também deveria inativar ou inibir 3 substâncias produzidas pelo vírus e muito prejudiciais ao organismo: (a) a protease 3CLpro viral, secretada pelo vírus, que promove a inativação do interferon do hospedeiro, a primeira linha de defesa das células hospedeiras, degradando o sistema imunitário do hospedeiro; (b) a protease viral PLpro, que é responsável pela maturação do vírus e impede que seja eliminado pelo hospedeiro, ao inibir a ubiquitina, proteína que reconhece as proteínas prejudiciais ao organismo humano e assinala que devem serem eliminadas; (c) a proteína não estrutural do domínio único SARS (SUD), que regula a replicação viral, combate a resposta imune da célula hospedeira infectada, enfraquece as defesas imunológicas hospedeiro e garante a sobrevivência do vírus. A função imunológica reprimida em pacientes com COVID-19 é reflexo dessas ações. Em resumo: três proteínas virais seriam importantes inativar pela droga antiviral que pretenda atuar contra o Covid-19: 3CLpro – PLpro – SUD, além de impedir a ocupação do ACE2 pelo vírus, segundo estudo de Garvin MR e col.
O estudo de Antonio Francès-Monerris e col, 2020, empregou simulações da dinâmica molecular avançada para avaliar IVM em vários alvos importantes de proteínas virais, revelou as bases moleculares dos mecanismos antivirais contra SARS-CoV-2 e constatou que todas essas áres importantes de serem inibidas por uma droda que trate o Covid-19 são realizadas pela IVM:
- inibição direta da entrada do SARSCoV-2 na célula hospedeira, ao mesmo tempo que garante a função fisiológica normal de ACE2 e, assim, evitando os efeitos indesejados do cancelamento desta função pela IVM.
- inibe o sítio ativo de ambas as proteases virais 3CLpro e PLpro contribuindo para inibir a maturação do vírus após a infecção, ajudando o sistema imunológico a se recuperar.
- impede a interação entre o SUD viral e o RNA humano, que são reconhecidos como mecanismos usados por coronavírus para enfraquecer as defesas imunológicas do hospedeiro e, portanto, garantir a sobrevivência do vírus.
Nas simulações da dinâmica molecular da ivermectina Antonio Francès-Monerris e col demonstrou a ação antiviral da IVM contra múltiplos alvos, além da já conhecida capacidades da ivermectina para bloquear o transporte de proteínas virais para os núcleos celulares mediados pelas importinas α / β1, que explicam o alto nível de atividade observada anti-SARS-CoV-2 da ivermectina: interferência com a célula infectada; a inibição da replicação viral e a capacidade de impedir o ataque ao sistema imunológico do hospedeiro.
Os autores concluem que a ivermectina deve ser considerada um agente multialvos, capaz de interferir em diferentes etapas chaves do ciclo de multiplicação do SARS-CoV2, o que provavelmente explica a recuperação rápida do paciente infectado pelo Covid-19 quando administrado a ivermectina, já descrita por inúmeros pesquisadores e médicos que a utilizaram.